
Саенко И.В., Черникова Л.А., Пойдашева А.Г., Хижникова А.Е., Кремнева Е.И., Морозова С.Н., Коновалов Р.Н., Козловская И.Б.
В статье обсуждаются исследования, которые проводились совместно отделом сенсомоторной физиологии и профилактики Института медико-биологических проблем РАН и Научным центром неврологии в течение последних 8 лет, по изучению нейропластических изменений в коре головного мозга, вызванных применением механической стимуляции опорных рецепторов и мягкого мультимодального экзоскелетонного комплекса «Регент» у здоровых лиц и постинсультных больных. В результате проведенных исследований была разработана пассивная сенсомоторная фМРТ-парадигма с использованием подошвенного имитатора опорной нагрузки «Корвит» для имитации локомоции как у здоровых людей, так и у пациентов с двигательным дефицитом. Показано, что как включение механической стимуляции опорных зон стоп в реабилитационном комплексе у больных с острым инсультом в первые дни заболевания, так и применение мультимодального экзоскелетонного комплекса «Регент» у больных с постинсультными гемипарезами в более поздние периоды инсульта приводят к улучшению характеристик функции ходьбы, что сопровождается реорганизацией корковых структур с формированием паттерна активации супраспинальных систем контроля локомоции.
Ключевые слова: нейропластичность, функциональная магнитно-резонансная томография, сенсомоторная пассивная фМРТ, постинсультные больные, локомоция, нейрореабилитация.
NEUROPLASTIC CHANGES IN THE CEREBRAL CORTEX CAUSED BY THE USE OF MECHANICAL STIMULATION OF THE SUPPORT RECEPTORS AND THE SOFT MULTIMODAL EXOSKELETON COMPLEX «REGENT» IN HEALTHY INDIVIDUALS AND POST-STROKE PATIENTS
Saenko I.V., Chernikova L.A.,Poydasheva A.G., Khizhnikova A.E.,Kremneva E.I., Morozova S.N.,Konovalov R.N., Kozlovskaya I.B.
The article discusses the investigations that were conducted in common by the Department of Sensomotor Physiology and Prevention of the Institute of Medical and Biological Problems of the Russian Academy of Sciences and the Research Center of Neurology during the last 8 years. The investigations studied the neuroplasticity changes in the cerebral cortex caused by the use of mechanical stimulation of the supporting receptors and the soft multimodal exoskeleton complex «Regent» in healthy individuals and post-stroke patients. As a result of the research, a passive sensorimotor fMRI-paradigm was developed using the plantar imitator of the «Korvit» support load to simulate locomotion in healthy individuals and in patients with motor deficiency. It has been shown that both the inclusion of mechanical stimulation of the foot support zones in the rehabilitation complex in patients with acute stroke in the first days of the disease and so the use of the multimodal exoskeleton complex «Regent» in patients with post-stroke hemiparesis in later periods of stroke lead to an improvement in the characteristics of the walking function, which is accompanied by the reorganization of cortical structures with the formation of a pattern of activation of supraspinal locomotion control systems.
Key words: neuroplasticity, functional magnetic resonance imaging, sensorimotor passive fMRI, post-stroke patients,
locomotion, neurorehabilitation.
Авиакосмическая и экологическая медицина. 2017. Т. 51. № 7 (спецвыпуск). С. 60–66.
DOI: 10.21687/0233-528X-2017-51-7-60-66
Среди инновационных технологий, применяющихся в нейрореабилитации больных с постинсультными двигательными нарушениями, особое место занимают методы космической медицины, разработанные российскими учеными, такие, как механическая стимуляция опорных зон стопы с помощью аппарата «Корвит» и усиление проприоцептивной афферентации от суставов, связок и мышц за счет системы эластичных нагрузочных элементов (ЭНЭ), распределяющихся в соответствии с топографией антигравитационных мышц туловища и конечностей (мышц-антагонистов), с помощью мягкого мультимодального экзоскелетонного комплекса «Регент». В основе создания этих технологий лежат многолетние исследования, проводимые в Институте медико-биологических проблем РАН, которые показали, что влияние гравитации на сенсомоторную систему происходит через различные афферентные входы, преимущественно вестибулярные и опорные. Ранее считалось, что функционирование тонической мышечной системы поддерживается в основном вестибулярной системой, однако в работах И.Б. Козловской и соавт. [1, 2] была показана прямая роль опорной афферентации в контроле структурно-функциональной организации тонической мышечной системы. В серии экспериментов было установлено, что опорная афферентация выполняет роль триггера в системе позно-тонических реакций, облегчая (при наличии опоры) или тормозя (при ее отсутствии) включение тонических двигательных единиц; определяет координационный рисунок позных синергий; обеспечивает оптимальную стратегию позных коррекционных ответов.
В условиях безопорности снижается участие постуральных мышц в локомоторных движениях при одновременном увеличении доли участия фазных мышц; уменьшается поперечная жесткость и максимальная произвольная сила [3,4]. Установленные закономерности легли в основу разработки новых средств и методов профилактики и коррекции неблагоприятных эффектов невесомости, таких, как подошвенный имитатор опорной нагрузки «Корвит» и мягкий мультимодальный экзоскелетонный комплекс «Регент», используемых с высокой эффективностью в длительных космических полетах.
Впоследствии эти средства нашли применение в неврологической клинике для восстановления и коррекции, в первую очередь, нарушений позы и ходьбы. Но, несмотря на применение в течение последних 20 лет этих средств в комплексном лечении больных с постинсультными двигательными нарушениями, многие вопросы механизма их действия остаются недостаточно изученными. В частности, определенную трудность представляет изучение кортикальной реорганизации головного мозга, лежащей в основе нейропластических процессов, развивающихся при использовании этих средств реабилитации больных с постинсультными двигательными нарушениями.
В настоящее время одной из наиболее часто используемых методик функциональной нейровизуализации, позволяющей изучать активизацию различных зон коры головного мозга в ответ на выполнение определенных заданий (двигательных, когнитивных, речевых и т.д.), является фМРТ, основанная на феномене BOLD (blood oxygen level dependent) эффекта. Вместе с тем оценка кортикального контроля локомоции с помощью фМРТ представляется одной из наиболее сложных в техническом плане проблем. Для этого разрабатываются специальные фМРТ-парадигмы, в которых обследуемому предлагают воображать необходимое движение [5–9], или же используют различные приспособления и устройства для осуществления активного или пассивного сгибания-разгибания в голеностопном суставе, которое рассматривается как наиболее важная составляющая в акте ходьбы [10–13]. И те и другие задания имеют определенные ограничения: первый вариант с воображаемым движением довольно сложен для воспроизведения не только больными, но и здоровыми испытуемыми, требует определенных навыков и тренировки;второй вариант также мало доступен в следствии отсутствия устройств, которые можно было бы использовать в условиях сильного магнитного поля без выраженных артефактов. Кроме того, активные движения в нижних конечностях зачастую невозможны у пациентов с выраженным неврологическим дефицитом. Поэтому продолжаются активные поиски фМРТ-парадигм, которые позволят максимально точно воспроизвести процесс локомоции или отдельные его компоненты у всех категорий обследуемых.
С целью изучения нейропластических изменений в головном мозге, развивающихся в ответ на применение средств космической медицины, на базе ФГБНУ «Научный центр неврологии» совместно с отделом сенсомоторной физиологии и профилактики Института медико-биологических проблем РАН при активном участии член-корр. РАН, д.м.н. И.Б. Козловской был проведен комплекс клинико-нейровизуализационных исследований.
Методика
Исследования проводились в 3 этапа:
I этап. Разработка пассивной моторной фМРТ-парадигмы для оценки супраспинального контроля навыка ходьбы в норме и у пациентов с двигательным неврологическим дефицитом после перенесенного ишемического инсульта.
В исследовании приняли участие 19 здоровых добровольцев без патологии со стороны ЦНС и других систем, а также без изменения вещества головного мозга по данным МРТ в стандартных режимах, 9 мужчин и 10 женщин, средний возраст которых составил 38 (31,5–60) лет. Кроме того, в исследование были включены 43 пациента (13 женщин,30 мужчин), средний возраст 54 (46–60) года, с первичным ишемическим инсультом, из них с корково-подкорковой локализацией – 23 и с подкорковой– 20 больных. Инфаркт в правом полушарии большого мозга отмечался у 20 больных, в левом полушарии – у 23 больных. Давность инсульта на момент обследования составляла от 21 сут до 16 мес. У всех больных в клинической картине выявлялся постинсультный гемипарез со средней тяжестью пареза в ноге по шкале Fugl-Meyer 17 (12–25,3 баллов) (в норме – 34 балла). Все обследуемые были правши, доминирование правой руки подтверждалось с помощью Эдинбургского теста для определения рабочей руки [14]. Протокол исследования был одобрен Этическим комитетом ФГБНУ «НЦН», получено Информированное согласие от всех участников обследования.

Рис 1. Имитатор опорной нагрузки подошвенный «Корвит»
Для исследования функциональной реорганизации супраспинальных сенсомоторных систем использовался подошвенный имитатор нагрузки «Корвит» (рис. 1), который состоит из блока управления, блока питания, МРТ-совместимых воздуховодов и ортезов со встроенными в стельки пневмокамерами, закрепляющимися на ступнях обследуемого. Работа аппарата осуществляется по принципу создания пневмомеханического давления на соответствующие опорные зоны стопы с помощью пневмокамер, работающих в режимах реальных локомоций. Причем пневмокамеры вмонтированы в стельку таким образом, чтобы осуществлять стимуляцию участков ступней с максимальной плотностью проприорецепторов. Уникальность данного прибора состоит в том, что он позволяет имитировать показатели физического воздействия на стопу при ходьбе: величину давления, временные характеристики (длительность импульса, интервалы между воздействиями на пяточную и плюсневую опорные зоны и интервалы между воздействиями на правую и левую ногу). При подобном моделировании опорных реакций формируется мощный афферентный поток импульсации, который оказывает регулирующее действие на структуры ЦНС, контролирующие движение и моделирует сенсорный образ ходьбы.
В течение одной сессии сканирования у каждого испытуемого выполнялась парадигма (задание), которая была заранее прорепетирована до начала исследования и непосредственно в комнате сканирования. Парадигма имела блоковый дизайн, состоящий из 6 чередующихся блоков периода активации и периода покоя продолжительностью по 38 с каждый. Задание начиналось с периода покоя, во время которого любая стимуляция отсутствовала. Затем следовал период активации – стимуляции опорных зон стопы в режиме имитации медленной ходьбы с давлением на стопы 40 кПА и частотой 75 шагов/мин. Во время каждого блока было получено 10 серий изображений головного мозга. Общая продолжительность каждой парадигмы составляла 3 мин 53 с, за которые было получено всего 60 серий изображений головного мозга.
МРТ-данные были получены на МР-томографе с напряженностью магнитного поля 1,5 Т, Magnetom
Avanto фирмы Siemens, Erlangen (Германия). Исследование начиналось со стандартного режима Т2 турбо спин-эхо в аксиальной проекции для исключения патологических изменений вещества головного мозга. Для получения анатомических данных выполнялось исследование в режиме 3D-Т1 градиентное эхо (Т1-mpr) с получением набора из 176 сагиттальных срезов, покрывающих весь объем вещества мозга (время повторения (TR) – 1940 мс, время эхо (TE) – 3,1 мс, угол наклона – 15°, матрица – 256 х 256 мм, толщина среза – 1,0 мм, размер воксела – 1 х 1 х 1 мм). Затем последовательно были получены 2 набора функциональных данных (для каждой из парадигм) в режиме Т2*-градиентное эхо в аксиальной проекции (TR – 3800 мс, TE – 50 мс, угол наклона – 90°, матрица – 64 х 64 мм, толщина среза – 3,0 мм, размер воксела – 3 х 3 х 3 мм, 36 срезов в серии). Каждый Т2*-режим включал в себя 60 измерений всего объема вещества мозга.
Оценка полученных данных проводилась при помощи пакета для статистической обработки SPM5 (Welcome Trust Centre of Neuroimaging, London, UK) отдельно для каждой парадигмы на этапе препроцессинга. Все объемы функциональных данных были выровнены относительно первого для коррекции движения испытуемого, после чего средний функциональный файл линейно корегистрировался с соответствующим анатомическим файлом с последующей пространственной нормализацией первого (3 х 3 х 3 мм) и второго (1 х 1 х 1 мм) относительно стандартного пространства координат Монреальского неврологического института (Montreal Neurological Institute, MNI). Непосредственно перед статистическим анализом преобразованные функциональные данные размывались при помощи гауссовой функции размером кернеля 10 х 10 х 10 мм для увеличения соотношения сигнал – шум (за счет ослабления высокочастотного шума) и компенсации вариабельности строения извилин между субъектами. Статистические параметрические карты генерировались на основании повоксельного сравнения при помощи общей линейной модели (General Linear Model) [15]. Для снижения артефактов от движения обследуемого параметры ригидной трансформации при выравнивании вводились в качестве регрессоров при статистической обработке первого уровня (для каждого испытуемого). При групповом анализе применялась модель со случайными уровнями факторов (Random Effects Model), с установленным порогом статистической значимости p < 0,001 (без коррекции) для выявления значимых зон активации. В результатах представлены только зоны активации (кластеры) с pкоррект < 0,05 на кластерном уровне.
II этап. Изучение влияния механической стимуляции опорных зон стоп на восстановление двигательных нарушений и функций опоры и ходьбы, а также на реорганизацию корковых областей у больных в остром периоде инсульта.
В работу было включено 56 пациентов: 32 мужчины и 24 женщины в возрасте от 31 до 81 года, средний возраст 61 (55-65) год, поступивших на лечение в острейшем периоде инсульта (1–7-е сутки), средний срок поступления 1 (1–3) сутки острого нарушения мозгового кровообращения. Тяжесть инсульта по шкале NIHSS – 11 (9–14) баллов, что соответствует инсульту средней степени тяжести. Степень двигательного дефицита в ноге по шкале Fugl-Meyer – 4 (3-8) балла (в норме – 34 балла). Все испытуемые не имели противопоказаний для проведения МРТ-исследований и подписали информированное согласие о добровольном участии в исследовании.
Основную группу составили 32 больных, у которых с первых часов развития инсульта, помимо традиционной восстановительной терапии, включающей лечебную гимнастику, массаж и нервно-мышечную электростимуляцию, применялась механическая стимуляция опорных зон стоп с помощью устройства «Корвит». Контрольная группа
включала 24 больных, которые получали только традиционную терапию. Механическая стимуляция
опорных зон стоп проводилась в основной группе на аппарате «Корвит» в режиме медленной ходьбы.
Стимуляция проводилась 2 раза в сутки по 20 мин 5 раз в неделю, в течение 3 нед.
III этап. Изучение реорганизации корковых зон мозга, ответственных за локомоцию, при использовании в комплексном лечении постинсультных больных мультимодального экзоскелетонного комплекса (МЭК) «Регент».
В исследовании принимали участие 14 больных, средний возраст 50,3 (49–62) года, перенесших ишемический инсульт с локализацией очага поражения в подкорковых зонах, с давностью заболевания в среднем 14,2 (7,0–23,0) мес. У 7 больных наблюдалось поражение правого полушария и у остальных 7 больных – левого. Все больные имели умеренный или легкий парез ноги со средней тяжестью пареза по шкале Fugl-Meyer 22,2 (17,0–27,0) балла (в норме – 34 балла). Все больные могли пройти 10 м без какой-либо помощи. Все испытуемые не имели противопоказаний для проведения МРТ-исследований и подписали Информированное согласие о добровольном участии в исследовании.
Пациенты, перенесшие ишемический инсульт, помимо стандартных реабилитационных мероприятий, занимались кинезотерапией с использованием МЭК (10 занятий 5 раз в нед). Занятия проводились не ранее, чем через 2 ч после еды, при постоянном контроле за физическим состоянием пациентов (контроль АД, ЧСС).
Важнейшим элементом МЭК «Регент» (рис. 2) являются эластичные нагрузочные элементы (ЭНЭ), с помощью которых производилась аксиальная нагрузка на пациента путем регулирования силы натяжения ЭНЭ с ориентацией как на больную, так и на здоровую сторону. Натяжение ЭНЭ производилось таким образом, чтобы обеспечить правильную установку нижних конечностей, отвечая мышечным сопротивлением на приложенную силу, либо способствовать пассивному включению в физиологическую синергию, формирующуюся под воздействием МЭК «Регент» и способствующую нормализации шаговых движений. С помощью ЭНЭ на жилете корректировалось правильное положение плеч и торса. Таким образом, достигалось выраженное уменьшение асимметрии позы. Первые 1–2 занятия осуществлялся индивидуальный подбор оптимальной степени натяжения ЭНЭ, выбор типа которых
зависел от индивидуальных особенностей пациента (роста, объема, диагноза) и варианта их крепления на опорных элементах.
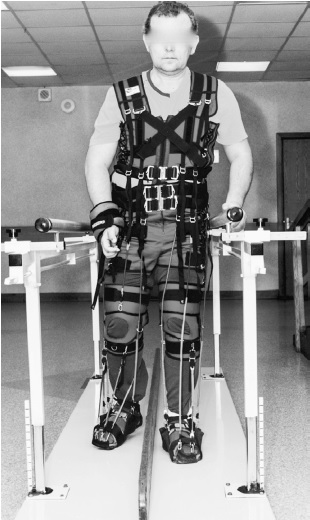
Рис. 2. Мультимодальный экзоскелетонный комплекс«Регент»
Результаты и обсуждение
Результаты I этапа исследований
При фМРТ с помощью пассивной сенсомоторной парадигмы – механической стимуляции опорных зон стоп в режиме имитации медленной ходьбы – в группе здоровых добровольцев были локализованы участки активации первичной сенсорной коры (S1), включающие обширные двусторонние зоны активации в парацентральных дольках, а также в первичной моторной коре (М1), что доказывает действенность данной парадигмы для имитации именно активных движений. Важно отметить двустороннюю активацию дополнительной моторной зоны (SMA), которая, как считают, активизируется при намерении выполнить действие (при этом само действие может и не последовать) и его прогнозировании, а также при стимуляции движения без его выполнения, что и происходило в нашем задании.
Также была получена активация задних теменных областей, а именно области нижних теменных долек IPL (больше слева). Данные участки играют важную роль в оценке когнитивных стратегий и моторных программ, вовлеченных при последовательных движениях ногами. Таким образом, при использовании у испытуемых пассивной сенсомоторной фМРТ-парадигмы отмечается обширная активация области первичной и вторичной сенсомоторной коры, участвующей в контроле локомоции (рис. 3).
Что касается больных, то по данным фМРТ с использованием предложенной нами парадигмы
активировались те же области, что и у здоровых испытуемых. Однако активация этих зон имеет некоторые особенности в зависимости от локализации зоны инфаркта и периода ишемического инсульта. В группе больных с корково-подкорковой локализацией инсульта дезорганизация сенсомоторной системы в остром периоде сменяется паттерном контрлатеральной пластичности в восстановительном периоде с последующим подключением пораженного полушария в сроки более 1 года от момента начала заболевания (рис. 4). В группе с подкорковой локализацией очага поражения паттерн активации сенсомоторной коры в остром периоде остается сохранным, с преобладанием паттерна ипсилатеральной реорганизации в последующие периоды (рис. 5). В недавно проведенном исследовании [16] также были получены аналогичные данные при использовании «Корвита» у здоровых лиц.
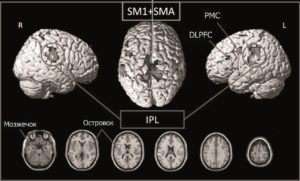
Рис. 3. Зоны активации головного мозга в группе здоровых добровольцев при выполнении парадигмы, наложенные на объемное изображение головного мозга (вверху) и срезы в аксиальной проекции (внизу). R – правое полушарие большого мозга; L – левое полушарие.
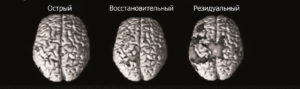
Рис. 4. Активация сенсомоторной коры в группе с корко- во-подкорковой локализацией ишемического инсульта в различные сроки.
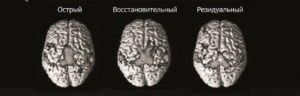
Рис. 5. Активация сенсомоторной коры в группе с подкор- ковой локализацией ишемического инсульта в различные сроки.
Результаты II этапа исследований
Проведенное исследование показало, что программа реабилитации, включающая механическую стимуляцию опорных зон стоп с первых часов развития инсульта, позволяет повысить эффективность реабилитационных мероприятий у больных основной группы, что проявлялось в более раннем (в среднем на 2 сут. по сравнению с контрольной группой) восстановлении баланса в положении сидя и стоя, а также функции ходьбы. Оказалось также, что применение «Корвита» в 1-е сутки после развития инсульта можно рассматривать как профилактическую меру развития спастичности в паретичной ноге.
С целью изучения влияния курса механической стимуляции стоп на реорганизацию корковых структур было выполнено сравнительное изучение данных фМРТ с использованием разработанной нами пассивной сенсомоторной парадигмы, имитирующей локомоцию, в первые сутки после инсульта и в конце острого периода (на 21-е сутки инсульта). При оценке фМРТ-данных, выполненных при поступлении, наблюдалась дезорганизация супраспинальных структур у всех больных, участвующих в исследовании, что согласуется с прежде полученными данными [17, 18]. При оценке фМРТ-данных на 21-е сутки инсульта у больных, в комплексное лечение которых была включена механическая стимуляция опорных зон стоп, отмечалось начало формирования характерного паттерна активации супраспинальных структур, контролирующих локомоцию. Так, активация первичной сенсомоторной коры SM1 (парацентральная долька) и дополнительной моторной коры SMA отмечалась в основном в контралатеральном полушарии, в то время как активация ассоциативной соматосенсорной области – правая и левая нижние теменные доли – превалировала на стороне очага в ипсилатеральном полушарии.
Можно предположить, что эффективность включения механической стимуляции опорных зон стоп в раннюю реабилитацию больных с острым инсультом (уменьшение выраженности двигательного дефицита, более ранние сроки восстановлении баланса и функции ходьбы, нормализация мышечного тонуса) обусловлена, прежде всего, коррекцией позно-тонических нарушений в гравитационной мускулатуре ног и туловища, возникших в результате функциональной опорной депривации. Это предположение подтверждается результатами фМРТ, при которой были получены данные, свидетельствующие о том, что на фоне усиленного потока опорной афферентации, создаваемого механической стимуляцией опорных зон стоп от аппарата «Корвит», в течение 3 недель с момента развития инсульта наблюдается реорганизация супраспинальных структур, отвечающих за локомоцию, в виде начала формирования характерного паттерна активации. При этом ипсилатерально наблюдается преобладание активации чувствительных зон (вторичной сенсомоторной коры), а в контралатеральном полушарии превалирует активация первичной сенсомоторной коры и возникает активация дополнительной моторной коры.
Результаты III этапа исследований
При анализе клинической эффективности применения МЭК «Регент» были получены данные о достоверном повышении скорости ходьбы на 10 м. после курса лечения, при этом степень двигательных нарушений в ноге по шкале Fugl-Meyer достоверно не изменилась.
Данные фМРТ с парадигмой, имитирующей медленную ходьбу, обсчитывались суммарно по всей группе. Очаг поражения на всех иллюстрациях был справа. До начала реабилитационных мероприятий у пациентов выявлялись зоны активации в области первичной сенсомоторной и дополнительной моторных зон, а также в левой и правой нижней теменной долях. После реабилитационных мероприятий у пациентов выявлялось повышение более чем в 2 раза объема зоны активации в первичной сенсомоторной и дополнительной моторной коре и снижение объема зоны активации в нижних теменных долях с 2 сторон. При этом зона в первичной сенсомоторной и дополнительной моторной коре стала более «целостной» и сконцентрированной.
Проведенное исследование показало, что на фоне применения курса МЭК «Регент» у больных с постинсультными гемипарезами повышается скорость ходьбы, что сопровождается изменениями в зонах активности, выявляемых при фМРТ, свидетельствующими о положительном направлении нейропластических процессов: уменьшение зон активации во вторичных сенсорных областях (нижних теменных долях) с одновременным увеличением зоны активации в первичной сенсомоторной и дополнительной моторной областях.
По-видимому, эффективность применения МЭК «Регент» в комплексной реабилитации больных с постинсультными двигательными нарушениями связана с коррекцией патологических локомоторных синергий и нормализацией шаговых движений за счет перераспределения проприоцептивного потока от суставов, связок и мышц при использовании системы ЭНЭ, распределяющихся в соответствии с топографией антигравитационных мышц туловища и конечностей (мышц-антагонистов).
Выводы
1. Подошвенный имитатор опорной нагрузки «Корвит» может быть использован в фМРТ-исследованиях в качестве парадигмы для имитации локомоции как у здоровых людей, так и у пациентов с двигательным дефицитом.
2. Преимуществом отработанной нами парадигмы является автоматизация и объективизация стимуляции, которая проводится с постоянной силой и частотой и может быть воспроизведена многократно; задания требуют минимальной кооперации со стороны исследуемого.
3. Включение механической стимуляции опорных зон стоп в реабилитационном комплексе у больных с острым инсультом в первые дни заболевания, так и применение МЭК «Регент» у больных с постинсультными гемипарезами в более поздние периоды инсульта приводят к улучшению характеристик функции ходьбы, что сопровождается реорганизацией корковых структур с формированием паттерна активации супраспинальных систем контроля локомоции.
Список литературы
1. Kozlovskaya I.B., Vinogradova O.V., Sayenko I.V. et al. New approaches to countermeasures of the negative effects of microgravity in longterm space flights // Acta Astronaut. 2006. V. 59. P. 13.
2. Kozlovskaya I.B., Sayenko I.V., Sayenko D.G. et al. Role of support afferentation in control of the tonic muscle activity // Ibid. 2007. V. 60. P. 285.
3. Miller T., Ivanov O., Galanov D. et al. The method of support stimulation as a way to maintain activity of the tonic muscular system during functional support depri vation // J. Gravit. Physiol. 2005. V. 12. № 1. P. 149.
4. Grigoriev A.I., Kozlovskaya I.B., Shenkman B.S. The role of support afferents in organization of the tonic musclesystem // Rus. Physiol. J. 2004. V. 90. № 5. P. 508.
5. Iseki K., Hanakawa T., Shinozaki J. et al. Neural mechanisms involved in mental imagery and observation of gait // NeuroImage. 2008. V. 41. P. 1021–1031.
6. La Fougere C., Zwergal A., Rominger A. et al. Real versus imagined locomotion: A [18F]-FDG PET-fMRI comparison // Ibid. 2010. V. 50. P. 1589–1598.
7. Bakker M., De Lange F.P., Helmich R.C. et al. Cerebral correlates of motor imagery of normal and precision gait // Ibid. 2008. V. 41. P. 998–1010. DOI:10.1016/j. neuroimage.2008.03.020.
8. Blumen H.M., Holtzer R., Brown L.L. et al. Behavioral and neural correlates of imagined walking and walkingwhile- talking in the elderly // Hum. Brain Mapp. 2014. V. 35. P. 4090–4104. DOI:10.1002/hbm.22461.
9. Zwergal, A., Linn, J., Xiong, G. et al. Ageing of human supraspinal locomotor and postural control in fMRI // Neurobiol. Ageing. 2012. V. 33. P. 1073–1084. DOI: 10. 1016/ j.neurobiol ageing.2010.09.022.
10. Mehta J.P. Verber M.D. Wieser J.A. et al. A novel technique for examining human brain activity associated with pedaling using fMRI // J. of Neurosci. Methods. 2009. V. 179. P. 230–239.
11. Dobkin B.H., Firestine A., West M. et al. Ankle dorsiflexion as an fMRI paradigm to assay motor control for walking during rehabilitation // NeuroImage. 2004. V. 23. P. 370–381. DOI:10.1016/j.neuroimage.2004.06.008.
12. Sahyoun C., Floyer-Lea A., Johansen-Berg H., Matthews P.M. Towards an understanding of gait control: brain activation during the anticipation, preparation and execution of foot movements // Ibid. V. 21. P. 568–575. DOI:10.1016/j.neuroimage.2003.09.065.
13. Trinastic J.P., Kautz S.A., McGregor K. et al. An fMRI study of the differences in brain activity during active ankle dorsiflexion and plantarflexion // Brain Imaging Behav. 2010. V. 4. P. 121–131. DOI:10.1007/s11682-010-9091-2.
14. Henry J.D., Crawford J.R. A meta-analytic review of verbal fluency performance following focal cortical lesions //Neuropsychol. 2004. V. 18. № 2. P. 284–295.
15. Friston K.J., Holmes A.P., Worsley K.J. et al. Statistical parametric maps in functional imaging: A general linear approach // Human Brain Mapping. 1995. V. 2. № 4. P. 189–210.
16. Labriffe M., Annweiler C., Amirova L.E. et al. Brain activity during mental imagery of gait versus gait-like plantar stimulation: a novel combined functional MRI paradigm to better understand cerebral gait control // Front Hum. Neurosci. 2017. Mar. 611:106. doi: 10.3389/fnhum.2017.00106. eCollection 2017.
17. Kremneva E.I., Chernikova L.A., Konovalov R.N. et al. Activation of the sensorimotor cortex using a device for mechanical stimulation of the plantar support zones // Human Physiol. 2012. V. 38. № 1. С. 49–55.
18. Kremneva E.I., Saenko I.V., Chernikova L.A. et al. Specific Activation of Brain Cortical Areas in response to stimulation of the support receptors in healthy subjects and patients with focal lesions of the CNS // Ibid. 2013. V. 39. № 5. P. 524–529.



