
Е. И. Кремнева, И. В. Саенко, Л. А. Черникова, А. В. Червяков, Р. Н. Коновалов, И. Б. Козловская
Specifics of Activation of Cortex by Stimulation of Support Receptors in Healthy Subjects and in Patients with Lesions of CNS
E. I. Kremneva, I. V. Saenko, L. A. Chernikova, A. V. Chervyakov, R. N. Konovalov, I. B. Kozlovskaya
Базируясь на результатах фундаментальных исследований, выполнявшихся в интересах космической медицины, в ходе которых была раскрыта природа двигательных нарушений, выявлена ведущая роль опорного входа в регуляции позно-тонической системы млекопитающих. Развитие методики функциональной магнитно-резонансной томографии (фМРТ) позволило изучить in vivo активность различных участков мозга при стимуляции опорной афферентации. Целью нашей работы было выявление особенностей активации зон коры головного мозга при стимуляции опорного входа в норме и при очаговых поражениях ЦНС. Были обследованы 19 здоровых добровольцев, (средний возраст составил 38 ± 15, 13 лет) и 23 пациента с корково-подкорковой локализацией ишемического инсульта (средний возраст 53 ± 9.07 года), которым проводилась фМРТ. Во время сканирования каждому испытуемому была проведена стимуляция опорных зон стопы в режиме имитации медленной ходьбы; использовался блоковый дизайн. В группе здоровых добровольцев значимая активация (pкоррект < 0.05 на кластерном уровне) была получена в первичной соматосенсорной коре, премоторной и дорсолатеральной префронтальной коре, островковой доле. У больных, перенесших инсульт, паттерн активации супраспинальных систем контроля локомоции четко формировался в зависимости от периода заболевания. При корково-подкорковой локализации инсульта в период восстановления функции ходьбы преобладает паттерн контралатеральной активации сенсомоторного модуля локомоции.
Ключевые слова: фМРТ, сенсомоторная кора, опорная афферентация, имитация медленной ходьбы. DOI: 10.7868/S0131164613050093
Results of basic studies in space medicine revealed the mechanism of motor disorders and the importance of support input in regulation of the tone and posture system of the mammals. Progress in functional magnetic resonance tomography (fMRT) enabled in vivo estimation of activity of various parts of the brain during stimulation of support afferent pathways. The goal of our study was to detect specific activation of the cortex during stimulation of support input in healthy subjects and in patients with lesions of CNS. The study included 19 healthy volunteers (mean age of 38 ± 15, 13 years) and 23 patients with cortical-subcortical ischemic stroke (mean age 53 ± 9.07); all subjects underwent fMRT. During scanning of each subject, support areas of the foot soles were stimulated to imitate slow walking using the block design. In healthy volunteers, primary somatosensory cortex, premotor and dorsolateral cortex, and insula were significantly activated (corrected <0.05 at cluster level). In patients with stroke, pattern of activation of the supraspinal systems of locomotion control clearly depended on the stage of the disease. In patients with cortical-subcortical stroke undergoing motility rehabilitation, the sensomotor locomotion module was predominantly activated as the contralateral pattern.
Keywords: fMRT, sensomotor cortex, support afferent pathways, imitation of slow walking.
В процессе филогенеза и онтогенеза двигательная система наземных животных и человека развивается в условиях гравитации и поэтому адаптирована к ней. В условиях нормальной гравитации внутри двигательной системы млекопитающих параллельно и во взаимосвязи друг с другом развиваются две субсистемы: 1) мышечно-фазическая система, обеспечивающая подвижность, 2) мышечно-тоническая система и система постурального контроля, обеспечивающие преодоление гравитационной силы. Влияние гравитации на сенсомоторную систему происходит через различные афферентные входы, преимущественно вестибулярные и опорные. До недавнего времени считалось, что функционирование тонической мышечной системы поддерживается, в основном, вестибулярной системой, в особенности сигналами отолитового аппарата. Однако в работах Козловской И.Б. и соавт. [1,2] была показана прямая роль опорной афферентации в контроле структурно-функциональной организации тонической мышечной системы. В серии экспериментов было установлено, что опорная афферентация выполняет роль триггера в системе позно-тонических реакций, облегчая (при наличииопоры) или тормозя (при ее отсутствии) включение тонических двигательных единиц (ДЕ); определяет координационный рисунок позных синергий; обеспечивает оптимальную стратегию позных коррекционных ответов. В условиях безопорности снижается участие постуральных мышц в локомоторных движениях при одновременном увеличении доли участия фазных мышц; уменьшается поперечная жесткость и максимальная произвольная сила [3, 4]. В настоящее время появился ряд исследований, в которых с помощью функциональной магнитно-резонансной томографии (фМРТ) выявлены корковые проекции рецепторов опоры в соматосенсорной коре [5, 6]. Однако экспериментальных данных о паттернах активации зон коры головного мозга при стимуляции опорной рецепции в режиме локомоторной активности нет.
Целью настоящей работы было исследование особенностей активации зон коры головного мозга при стимуляции опорного входа в норме и при очаговых поражениях ЦНС.
МЕТОДИКА
В группу здоровых добровольцев вошли 19 человек без патологии со стороны ЦНС и других систем: 9 мужчин и 10 женщин, средний возраст составил 38 ± 15,13 лет. Все обследуемые были правши. В группу с очаговыми поражениями вошли 23 пациента с корково-подкорковой (КПК) локализацией инфаркта в бассейне среднемозговой артерии, из них 18 мужчин и 5 женщин, средний возраст составил 53 ± 9.07 года. Инфаркт в правом полушарии большого мозга отмечался у 13 больных, в левом полушарии большого мозга – у 10 больных. Давность инсульта на момент обследования составляла 21 сутки у 5 пациентов, 2– 12 месяцев – у 9, более 1 года – у 9 пациентов. Все пациенты были правши.
В группу с очаговыми поражениями вошли 23 пациента с корково-подкорковой (КПК) локализацией инфаркта в бассейне среднемозговой артерии, из них 18 мужчин и 5 женщин, средний возраст составил 53 ± 9.07 года. Инфаркт в правом полушарии большого мозга отмечался у 13 больных, в левом полушарии большого мозга – у 10 больных. Давность инсульта на момент обследования составляла 21 сутки у 5 пациентов, 2–12 месяцев – у 9, более 1 года – у 9 пациентов. Все пациенты были правши.
Для исследования функциональной реорганизации супраспинальных сенсомоторных систем, в Научном центре неврологии РАМН совместно с сотрудниками Института медико-биологических проблем РАН была разработана оригинальная сенсомоторная фМРТ-парадигма, имитирующая опорную нагрузку при ходьбе в условиях магнитно-резонансного томографа (МРТ). В течение одной сессии сканирования каждому испытуемому выполнялась парадигма (задание), которая была заранее прорепетирована до начала исследования и непосредственно в комнате сканирования. Парадигма имела блоковый дизайн, состоящий из 6 чередующихся блоков периода активации и периода покоя, продолжительностью по 38 с каждый. Задание начиналось с периода покоя, во время которого любая стимуляция отсутствовала. Затем следовал период активации – стимуляции опорных зон стопы в режиме имитации медленной ходьбы с давлением на стопы 40 кПА и частотой 75 шагов/мин. Во время каждого блока были получены 10 серий изображений головного мозга. Общая продолжительность каждой парадигмы составляла 3 мин 53 с, за которые всего было получено 60 серий изображений головного мозга. Стимуляция опорной рецепции осуществлялась с помощью имитатора опорной нагрузки “Корвит”, разработанного совместно сотрудниками ГНЦ РФ ИМБП РАН и ООО “Центр авиакосмической медицины” (рис. 1). “Корвит” позволяет воспроизводить физиологические режимы реакции опоры, возникающие в процессе локомоции. Имитатор состоит из блока управления, блока питания, МРТ-совместимых воздуховодов и ортезов со встроенными в стельки пневмокамерами, закрепляющихся на ступнях обследуемого. Работа аппарата осуществляется по принципу создания пневмомеханического давления на соответствующие опорные зоны стопы с помощью пневмокамер, работающих в режимах реальных локомоций. Причем пневмокамеры вмонтированы в стельку таким образом, чтобы осуществлять стимуляцию участков ступней с максимальной плотностью механорецепторов. При подобном моделировании опорных реакций формируется мощный афферентный поток импульсации, который оказывает регулирующее действие на структуры ЦНС, контролирующие движение, и моделирует сенсорный образ ходьбы.

Рис. 1. Подошвенный имитатор опорной нагрузки “Корвит”
МРТ-данные были получены на МР-томографе с напряженностью магнитного поля 1.5 Т Magnetom Avanto (фирма Siemens, Erlangen, Германия). Исследование начиналось со стандартного режима Т2 турбо-спин эхо в аксиальной проекции для исключения патологических изменений вещества головного мозга. Для получения анатомических данных выполнялось исследование в режиме 3D-Т1 градиентное эхо (Т1-mpr) с получением набора из 176 сагиттальных срезов, покрывающих весь объем вещества мозга. Затем последовательно были получены 2 набора функциональных данных (для каждой из парадигм) в режиме Т2*-градиентное эхо в аксиальной проекции (время повторения (TR) – 3800 мс, время эхо (TE) – 50 мс, угол наклона – 90 град, матрица – 64 × 64 мм, толщина среза – 3.0 мм, размер воксела – 3 × 3 × 3 мм, 36 срезов в серии). Каждый Т2 режим включал в себя 60 измерений всего объема вещества мозга.
Оценка полученных данных проводилась при помощи пакета для статистической обработки SPM5 (Welcome Trust Centre of Neuroimaging, London, UK) отдельно для каждой парадигмы на этапе препроцессинга. Весь объем функциональных данных был выровнен относительно первого для коррекции движения испытуемого, после чего средний функциональный файл линейно корегистрировался с соответствующим анатомическим файлом с последующей пространственной нормализацией первого (3 × 3 × 3 мм) и второго (1 × 1 × 1 мм) относительно стандартного пространства координат Монреальского Неврологического Института – Montreal Neurological Institute (MNI).
Непосредственно перед статистическим анализом преобразованные функциональные данные размывались при помощи гауссовой функции с размером кернеля 10 × 10 × 10 мм для увеличения соотношения сигнал–шум (за счет ослабления высокочастотного шума) и компенсации вариабельности строения извилин между субъектами. Статистические параметрические карты генерировались на основании повоксельного сравнения при помощи общей линейной модели (general linear model). Для снижения артефактов от движения обследуемого параметры ригидной трансформации при выравнивании вводились в качестве регрессоров при статистической обработке первого уровня (для каждого испытуемого). При групповом анализе применялась модель со случайными уровнями факторов (random effects model) с установленным порогом статистической значимости p < 0.001 (без коррекции) для выявления значимых зон активации. В результатах выявляются только зоны активации (кластеры) с pкоррект < 0.05 на кластерном уровне.
По данным фМРТ-исследования для интересующих зон активации в каждом полушарии рассчитывались следующие характеристики: объем зоны активации, в мм3; координаты центра зоны активации в стандартном стереотаксическом пространстве MNI [x y z ], мм; для двусторонних зон активации – коэффициент латерализации K, рассчитываемый по формуле [R – L/R + L] (где R – объем активации в правом полушарии, L – объем активации в левом полушарии).
Для количественного анализа были выбраны зоны первичной и вторичной сенсомоторной коры (SM1 + SMA) и ассоциативная сенсорная зона (IPL) в обоих полушариях большого мозга, как наиболее значимые в акте ходьбы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате групповой обработки данных фМРТ в группе здоровых испытуемых были получены следующие зоны активации (FWE, p < 0.05): в обоих полушариях большого мозга – области парацентральной дольки (первичная сенсомоторная область SM1, поля Бродмана (ПБ) 1–4), верхнемедиальных отделов верхних лобных извилин (дополнительная моторная кора SMA, 6 ПБ), нижней теменной дольки (вторичная ассоциативная сенсорная область IPL, 40 ПБ), островковой дольки (13 ПБ); в левом полушарии большого мозга – в средней лобной извилине (премоторная кора PMС, 6 ПБ), в нижней лобной извилине (дорсолатеральная префронтальная кора, DLPFC, 45 ПБ), а также в обоих полушариях мозжечка (рис. 2).
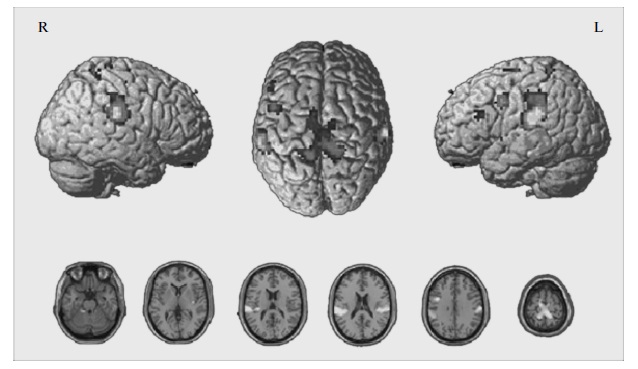
Рис. 2. Зоны активации для группы здоровых испытуемых (групповой анализ) при выполнении парадигмы, наложенные на объемное изображение головного мозга (вверху) и срезы в аксиальной проекции (внизу). R – правое полушарие большого мозга, L – левое полушарие.
Объем зоны активации SM1 + SMA для правого и левого полушарий по группе составил 3132 ± 1895.84 и 2511 ± 1807.88 мм3, соответственно, с количественным преобладанием активации справа. Коэффициент латерализации K составил 0.14 при лимитах К = 1 при активации только в правом полушарии и К = –1 при активации только в левом полушарии. При этом при попарном сравнении объем зоны справа преобладал у 11 испытуемых, слева – у 5 испытуемых. Однако достоверность различий по объему зоны активации между полушариями не была подтверждена (р > 0.05). Координаты центров кластеров по группе представлены в табл. 1.
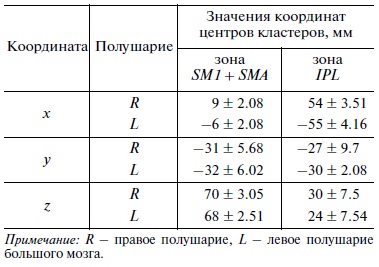
Таблица 1. Координаты центров кластеров зон интереса в группе добровольцев
При попарном сравнении координат x, y и z в правом и левом полушарии достоверных различий для каждой из координат получено не было (р > 0.05) (для координаты х для левого полушария брался модуль значений, поскольку знак “–” для данной координаты отражает лишь ее расположение в левом полушарии). Из этого следует, что зоны SM1 + SMA в правом и левом полушариях расположены симметрично.
Объем зоны активации IPL для правого и левого полушарий по группе составил 2106 ± 1486.47 и 3591 ± 1910.71 мм3, соответственно, с количественным преобладанием активации слева. Коэффициент латерализации K составил –0.14. При этом при попарном сравнении объем зоны справа преобладал у 6 испытуемых, слева – у 12 испытуемых. Преобладание активации в левом полушарии было достоверным (р = 0.02). Координаты центров кластеров по группе представлены в табл. 1. При попарном сравнении координат x, y и z в правом и левом полушарии достоверных различий для каждой из координат получено не было (р > 0.05) (для координаты х для левого полушария брался модуль значений). Из этого следует, что зоны IPL в правом и левом полушариях расположены симметрично, однако размеры зоны слева преобладают.

Таблица 2. Объем зон активации (мм3) по данным фМРТ у больных с корково-подкорковой локализацией очага
поражения в разные сроки заболевания
При очаговых поражениях на фоне стимуляции опорного входа, по данным фМРТ, в срок до 1 месяца отмечалась дезорганизация сенсомоторной системы, отвечающей за супраспинальный контроль локомоции, как в пораженном, так и в интактном полушарии, со значительным уменьшением размеров первичных и вторичных сенсомоторных зон. Объем зоны SM1 + SMA в пораженном полушарии составил 342 ± 96.23 мм3, в интактном – 282.5 ± 145.71 мм3 (табл. 2), то есть объем активации был значительно ниже группы нормы (объем зоны активации SM1 + SMA в группе нормы составил 3132 мм3 для правого полушария, 2511 мм3 – для левого, при этом объемы достоверно не отличались). Графическое отображение результатов представлено на рис. 3.
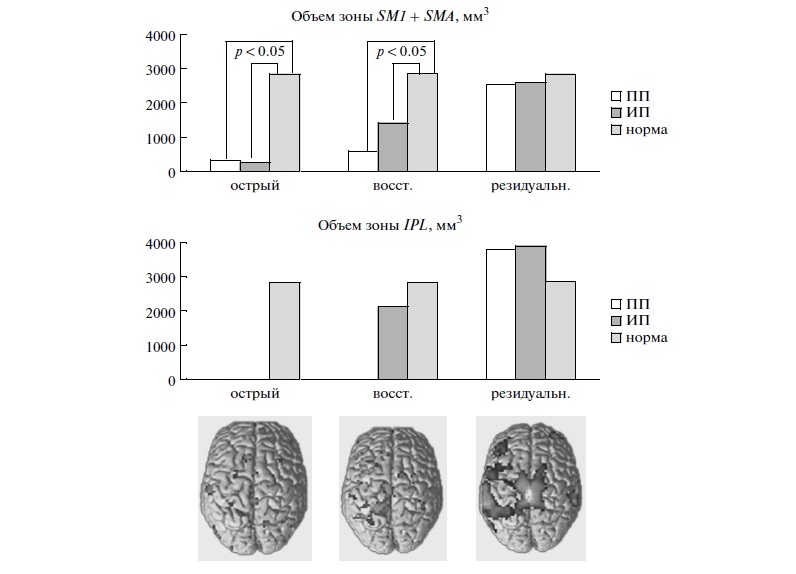
Рис. 3. Активация сенсомоторной коры в группе с корково-подкорковой локализацией ишемического инсульта в различные сроки. ПП – пораженное полушарие, ИП – интактное полушарие.
Координаты центров данной зоны активации для пораженного полушария достоверно не отличались от аналогичных показателей в группе нормы. Активация дополнительных ассоциативных зон IPL не определялась ни у одного больного ни в интактном, ни в пораженном полушарии. В остром периоде у больных с КПК локализацией инсульта корреляций между размерами зоны инфаркта и активацией зон SM1 + SMA в не пораженном и пораженном полушариях не было выявлено.
В сроки 2–12 месяцев объем зоны SM1 + SMA в пораженном полушарии составил 594 ± 465.83 мм3, то есть оставался значительно ниже группы нормы, в интактном – 1404 ± 501.54 мм3, то есть был снижен примерно в два раза по сравнению с группой нормы (табл. 2, рис. 3). При этом наблюдалось увеличение зоны активации в пораженном полушарии по сравнению с данными, полученными у больных сроком до 1 месяца. В то же время объем активации зоны SM1 + SMA в здоровом полушарии также преобладал над объемом активации аналогичной зоны в пораженном полушарии, как и у больных со сроком инсульта до 1 месяца. Координаты центров данной зоны активации для пораженного полушария достоверно не отличались от аналогичных показателей в группе нормы. Кроме того, в этот период регистрировалась активность дополнительной ассоциативной зоны IPL в интактном полушарии. В пораженном полушарии активации этой зоны не выявлялась в сроки до 1 года.
При корреляции объема очага и зоны активации выявлена тенденция к обратной связи между размером очага и объемом зоны активации SM1 +± SMA в здоровом полушарии (r = –0.5; p = 0.25).
При исследовании системы супраспинального контроля ходьбы группы больных с инсультом давностью более 1 года (резидуальный период инсульта) отмечалось появление активации дополнительной ассоциативной зоны IPL, и в интактном, и в пораженном полушарии, которая по своим размерам стала даже несколько превосходить аналогичную в группе нормы (рис. 3).
Объем зоны SM1 + SMA в пораженном полушарии составил 2538 ± 1300 мм3, в интактном – 2572 ± 1606.54 мм3, то есть был сопоставим с группой нормы (табл. 2, рис. 3). При этом объем активации в пораженном и здоровом полушарии достоверно не различался. Координаты центров зоны активации SM1 + SMA для пораженного полушария достоверно не отличались от аналогичных показателей в группе нормы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
С помощью предложенной нами парадигмы – стимуляции опорных зон стоп в режиме имитации медленной ходьбы – в группе здоровых добровольцев были локализованы участки активации головного мозга, схожие с данными классической нейрофизиологии и работами исследователей в области функциональной нейровизуализации [7, 8]. В режиме имитации медленной ходьбы участки активации первичной сенсорной коры (S1) являлись частью обширных двусторонних зон активации в парацентральных дольках, включающих в себя и первичную моторную кору (М1), что доказывает действенность данной парадигмы для имитации именно активных движений. Важно отметить двустороннюю активацию 6 ПБ, к которому относится латеральная (премоторная) зона, часто обозначаемая в иностранной литературе как SMA – supplementary motor area. Считается, что SMA активизируется при намерении выполнить действие (при этом само действие может и не последовать) и его прогнозировании [8]. Как следствие подобных функций SMA, в работах исследователей была продемонстрирована роль этой зоны в инициировании и прекращении процесса ходьбы [9–11].
Также была получена активация задних теменных областей, представляющих собой сложную ассоциативную кору, а именно в области нижних теменных долек IPL (больше слева) (40 ПБ). Данные участки играют важную роль в оценке когнитивных стратегий и моторных программ, вовлеченных при последовательных движениях ногами [12, 13]. Причем в литературе отмечается тот факт, что активация нижней теменной дольки при выполнении сложных двигательных актов у правшей преобладает в левом полушарии [14], что подтверждается развитием двухсторонней апраксии при повреждениях левого полушария большого мозга [15].
Таким образом, при опорной стимуляции отмечается распространенная активация сенсомоторной коры, участвующей в осуществлении локомоции. Конечно, вполне закономерным является сомнение касательно того, что парадигма не отражает реальную локомоцию, поскольку испытуемый лежит и не производит никаких движений. Однако доказано, что афферентация, возникающая при ритмичной стимуляции опорных зон стопы с частотой и нагрузкой, сопоставимыми с таковыми при реальной ходьбе, играет важную роль в поддержании супраспинального контроля [1, 2]; более того, полученные нами данные сопоставимы с данными других исследовательских групп, использовавших парадигмы с воображением ходьбы [8, 9, 16–19].
У пациентов с ишемическим инсультом в остром периоде (исследование на 21 сутки) с корково-подкорковой локализацией очага отмечалась дезорганизация активации сенсомоторной системы (объем первичной сенсомоторной зоны SM1 + SMA в обоих полушариях большого мозга был уменьшен в 7.3 и более раз по сравнению с группой нормы, практически не визуализировалась активация вторичных и третичных сенсомоторных зон).
Такие данные исследования в этот период могут быть связаны со степенью поражения вещества головного мозга: инфаркты корково-подкорковой локализации в нашем исследовании были большие по размерам и связаны с патологическими изменениями в более крупных сосудах, соответственно, выраженность перифокального отека и нарушение гемодинамики как в ядре инфаркта также были значительные. Эти факторы в совокупности с поражением коркового вещества и обусловливают дезинтеграцию сенсомоторной системы в данной группе. Причем эта дезинтеграция выявляется не только в пораженном, но и в условно интактном полушарии, что может свидетельствовать о более глубоком нарушении гемодинамических процессов во всем веществе головного мозга в ответ на повреждение того или иного его участка.
В восстановительный и резидуальный периоды показано преобладание паттерна контралатеральной реорганизации, которая происходит в основном за счет усиления активации зон SM1 + SMA и IPL в непораженном полушарии (которые стремятся к показателям, характерным для нормы) с последующим подключением пораженного полушария в срок более 1 года от момента начала заболевания. Кроме того, в восстановительном периоде в группе с КПК локализацией инсульта отмечалось увеличение количества зон активации ассоциативной сенсомоторной коры в интактном полушарии. Аналогичные изменения при КПК локализации отмечаются и по данным литературы [20, 21] и могут объясняться тем фактом, что выполнение даже простейших движений может приводить к вовлечению обширной межполушарной сети, поскольку даже такие задания воспринимаются мозгом как сложные; поэтому вовлекается не только зона М1 в интактном полушарии, но и многочисленные ассоциативные зоны, также в норме включающиеся в ответ на сложные движения. Сторонники данной гипотезы приводят в пример исследования со здоровыми добровольцами, где появление активации в ипсилатеральном полушарии возникает во время выполнения сложных заданий или при работе не доминантной руки, указывая таким образом на некоторую межполушарную кооперацию [22].
ЗАКЛЮЧЕНИЕ
Как известно, раздражение опорных рецепторных зон играет существенную роль в организации тонических реакций мышечного аппарата и вносит значительный вклад в обеспечение активности экстензорных моторных центров. В нашем исследовании была показана активация различных сенсомоторных и других зон коры под влиянием механической стимуляции опорных рецепций при помощи аппарата “Корвит”, как в норме, так и при очаговом поражении головного мозга. На основании этого можно сделать следующие выводы:
1. При стимуляции опорной рецепции в режиме ходьбы в группе здоровых добровольцев активируются первичная сенсомоторная кора (зона SM1 симметрично в обоих полушариях большого мозга); вторичная моторная (зона SMA симметрично в обоих полушариях, PMC – преимущественно слева) и сенсорная кора (зона IPL в обоих полушариях с количественным преобладанием слева); третичная моторная кора (зона DLPFC – в левом полушарии большого мозга).
2. У больных, перенесших острое нарушение мозгового кровообращения, паттерн активации супраспинальных систем контроля локомоции отличается по объему от паттерна активации у здоровых добровольцев, но при этом совпадает по координатам центров кластеров изучаемых зон.
3. У больных, перенесших инсульт, паттерн активации супраспинальных систем контроля локомоции формируется в зависимости от периода заболевания.
4. При корково-подкорковой локализации инсульта в период восстановления функции ходьбы преобладает паттерн контралатеральной активации сенсомоторного модуля локомоции.
СПИСОК ЛИТЕРАТУРЫ
1. Kozlovskaya I.B., Vinogradova O.V., Sayenko I.V. et al. New approaches to countermeasures of the negative effects of microgravity in longterm space flights // Acta Astronautica. 2006. V. 59. P. 13.
2. Kozlovskaya I.B., Sayenko I.V., Sayenko D.G. et al. Role of support afferentation in control of the tonic muscle activity // Acta Astronautica. 2007. V. 60. P. 285.
3. Miller T., Ivanov O., Galanov D. et al. The method of support stimulation as a way to maintain activity of the tonic muscular system during functional support deprivation // J. Gravit. Physiol. 2005. V. 12. № 1. P. 149.
4. Grigoriev A.I., Kozlovskaya I.B., Shenkman B.S. The role of support afferents in organization of the tonic muscle system // Rus. Physiol. J. 2004. V. 90. № 5. P. 508.
5. Golaszewski S.M., Siedentopf C.M., Baldauf E. et al. Functional magnetic resonance imaging of the human sensorimotor cortex using a novel vibrotactile stimulator // Neuroimage. 2002. V. 17. P. 421.
6. Ying Hao, Brad Manor, Jing Liu et al. Novel MRI-compatible tactile stimulator for cortical mapping of foot sole pressure stimuli with fMRI // Magnetic Resonance in Medicine. 2013. V. 69. P. 1194.
7. Golaszewski S.M., Siedentopf C.M., Koppelstaetter F.et al. Human brain structures related to plantar vibrotactile stimulation: A functional magnetic resonanceimaging study // NeuroImage. 2006. V. 29. P. 923.
8. Sacco K., Cauda F., Cerliani L. et al. Motor imagery of walking following training in locomotor attention. The effect of “the tango lesson” // NeuroImage. 2006. V. 32 (3). P. 1441.
9. Crenna P., Frigo C. A motor programme for the initiation of forward-oriented movements in humans // J. Physiol. 1991. V. 437. P. 635.
10. Jian Y., Winter D.A., Ishac M.G., Gilchrist L. Trajectory of the body COG and COP during initiation and termination of gait // Gait Posture. 1993. № 1. P. 9.
11. McFadyen B., Winter D.A. Anticipatory locomotor adjustments during obstructed human walking // Neurosci. Res. 1991. № 9. P. 37.
12. Lafleur M.F., Jackson P.L., Malouin F. et al. Motor learning produces parallel dynamic functional changes during the execution and imagination of sequential foot movements // Neuroimage. 2002. V. 16 (1). P. 142.
13. Jackson P.L., Lafleur M.F., Malouin F. et al. Functional cerebral reorganization following motor sequence learning through mental practice with motor imagery // Neuroimage. 2003. V. 20 (2). P. 1171.
14. Gerardin E., Sirigu A., Lehericy S. et al. Partially overlapping neural networks for real and imagined hand movements // Cereb. Cortex. 2002. V. 10 (11). P. 1093.
15. De Renzi E., Faglioni P., Sorgato P. Modality-specific and supramodal mechanisms of apraxia // Brain. 1982. V. 105 (2). P. 301.
16. Iseki K., Hanakawa T., Hashikawa K. et al. Gait disturbance associated with white matter changes: A gait analysis and blood flow study // NeuroImage. 2010. V. 49. P. 1659.
17. Jahn K., Deutschlander A., Stephan T. et al. Brain activation patterns during imagined stance and locomotion in functional magnetic resonance imaging // NeuroImage. 2004. V. 22. P. 1722.
18. Lotze M., Montoya P., Erb M. et al. Activation of cortical and cerebellar motor areas during executed and imagined hand movements: an fMRI study // J. Cogn. Neurosci. 1999. V. 11 (5). P. 491.
19. Nair D.G., Purcott K.L., Fuchs A. et al. Cortical and cerebellar activity of the human brain during imagined and executed unimanual and bimanual action sequences: a functional MRI study // Brain Res. Cogn. Brain Res. 2003. V. 15 (3). P. 250.
20. Cao Y., D’Olhaberriague L., Vikingstad E.M. et al. Pilot study of functional MRI to assess cerebral activation of motor function after poststroke hemiparesis // Stroke. 1998. № 29. P. 112.
21. Cramer S.C., Moore C.I., Finklestein S.P., Rosen B.R. A pilot study of somatotopic mapping after cortical infarct // Stroke. 2000. № 31. P. 668.
22. Calautti C., Baron J.C. Functional neuroimaging studies of motor recovery after stroke in adults // Stroke. 2003. № 34. P. 1553.



